【www.ythhrz.com--考试资讯】
高考即将来临,在考前多做一些模拟试卷对考生有很大帮助。以下是烟花美文网小编为你整理的2018年高考必做化学试题及答案,希望能帮到你。
2018年高考必做化学试题题目
相对原子质量c-12、H-1、O-16、Cl-35.5、Br-79.9、Ca-40、I-127
选择题(本题包括14小题,每小题4分,共56分)
1.若司机酒后驾车,可通过对其呼出的气体进行检验而查出,所利用的化学反应如下:2CrO3(红色)+3C2H5OH+3H2SO4Cr2(SO4)3(绿色)+3CH3CHO+6H2O。关于该反应,下列叙述不正确的是( )
A.1 mol CrO3发生氧化反应,转移3 mol e-
B.C2H5OH是还原剂
C.CrO3在反应中表现氧化性
D.C2H5OH在反应中失去电子

3.铊(Tl)与铝同族。Tl3+在酸性溶液中能发生反应:Tl3++2AgTl++2Ag+下列推断错误的是
A.Tl+的最外层有1个电子
B.Tl能形成+3价和+1价的化合物
C.酸性溶液中Tl3+比Tl+氧化性强
D.Tl+的还原性比Ag弱
4.根据如图的转化关系判断下列说法不正确的是(反应条件已略去)( )
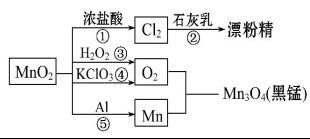
A.反应①②③④⑤均属于氧化还原反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶2
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
5.等质量的氯气与下列足量物质反应,转移的电子数最少的是( )
A.冷的NaOH溶液
B.SO2的水溶液
C.FeCl2溶液
D.铜
6.已知Cu2S与某浓度的硝酸反应时,生成硝酸铜和硫酸,若反应中Cu2S与HNO3的物质的量之比为2∶13,则该反应的还原产物为( )
A.N2O
B.NO
C.NO2
D.N2O3
7.CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2溶液变成无色。下列说法不正确的是( )
A.滴加KI溶液时,KI被氧化,CuI是还原产物
B.通入SO2后,溶液变无色,体现SO2的还原性
C.整个过程发生了复分解反应和氧化还原反应
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
8.某反应体系中的物质有NaOH、Au2O3、Na2S4O6、Au2O、H2O、Na2S2O3。Au2O3为反应物,则下列有关说法正确的是( )
A.该反应体系中有三种元素的价态发生了变化
B.Au2O在反应中作还原剂
C.Na2S2O3发生还原反应
D.1 mol Au2O3发生反应,转移电子4 mol
9.下列各装置能够达到相应实验目的的是( )

A.用装置甲除去乙酸乙酯中混有的少量乙酸
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙制取无水MgCl2
D.用装置丁制取乙烯
10.下列有关实验操作、现象和解释或结论都正确的是( )
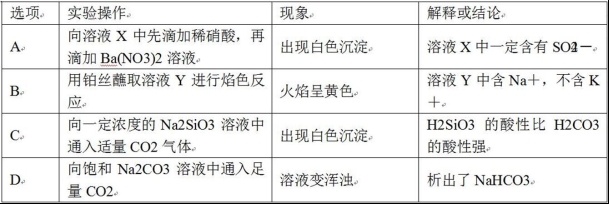
11.对于实验Ⅰ~Ⅳ的描述正确的是( )

A.实验Ⅰ:逐滴滴加稀盐酸时,试管中立即产生大量气泡
B.实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验Ⅲ:从饱和食盐水中提取氯化钠晶体
D.实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去
12.下列有机物命名及其一氯代物的同分异构体数目正确的是( )
命名 一氯代物 A 2甲基2乙基丙烷 4 B 1,3二甲基苯 3 C 2,2,3三甲基戊烷 6 D 2,3二甲基4乙基己烷 7
13.下列说法不正确的是( )
A.苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为
B.(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出
C.醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物
D.迷迭香酸的结构为它可以发生酯化、水解、加成等反应

14.甲、乙、丙三种有机物的结构简式如下图所示,下列说法不正确的是( )

A.甲、乙、丙都能发生加成反应、取代反应
B.丙与C6H5OH都含有—OH,质谱图显示的质荷比最大值相差14,但不属于同系物
C.淀粉、油脂、有机玻璃等都属于高分子化合物
D.乙的化学名称为苯乙烯,能使溴水褪色,但不存在顺反异构体
二、必做题(本题包括2小题,共28分)
15(14分) 实验室从含碘废液中测定I-的含量以及碘的回收过程如下:
Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00mL废液于250mL锥形瓶中,分别加入5mL2mol·L-1H2SO4溶液和10mL20% NH4Fe(SO4)2·12H2O溶液,摇匀,小火加热蒸发至碘完全挥发,取下锥形瓶冷却后,加入10mL2mol·L-1 H2SO4溶液,加入几滴二苯胺磺酸钠(用作指示剂),用0.0250mol·L-1标准K2Cr2O7溶液进行滴定到终点。重复3次,数据记录见下表:(已知反应①2Fe3++2I-===2Fe2++I2②6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O)
次数 1 2 3 滴定体积/mL 19.60 19.65 19.55Ⅱ.碘的回收
取250mL含碘废液于烧杯中,加入Na2S2O3溶液,并将饱和CuSO4溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应生成CuI沉淀。过滤,得到的CuI沉淀按图1进行操作,检查装置的气密性后,从分液漏斗中逐滴加浓硝酸(注意滴液的速度),完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液,然后按图2进行粗碘的提纯。

请回答下列问题:
(1)简述图2实验装置中烧瓶的作用_______________。
(2)某同学欲配制200mL2mol·L-1的H2SO4,配制方法合理的是________。
A.在200mL1mol·L-1的H2SO4中加入22.4L标准状况下的SO3
B.向100mL4mol·L-1的H2SO4中加入100mL水
C.取5mol·L-1的H2SO4 80.0mL,加水至200mL
D.将16g NaOH固体加入到200mL3mol·L-1的H2SO4溶液中
(3)在盛有废液的锥形瓶中先加入5mL 2mol·L-1H2SO4的目的是________。
(4)根据滴定的有关数据,计算该废液中I-的含量为______g·L-1。
(5)写出图1锥形瓶中发生反应的化学方程式_____________。
(6)按图2装置进行粗碘提纯,采用的分离方法是________,a、b为冷凝水进出口,其中________(填“a”或“b”)接水龙头,最终能得到较多较高纯度的单质碘。
16(14分)某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。
请回答下列问题:

(1)冷凝管所起的作用为冷凝回流和________,冷凝水从________口进入(填“a”或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。Ⅲ中小试管内苯的作用是___________。
(3)能说明苯与液溴发生了取代反应的现象是_________
(4)反应结束后,要让装置I中的水倒吸入装置Ⅱ中。这样操作的目的是___________,简述这一操作的方法______
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液;
③再用蒸馏水洗涤,振荡,分液;④加入无水CaCl2粉末干燥;⑤_____(填操作名称)。
三.选择题(任选一题)
17(16分)过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:

已知:CaO2·8H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。
(1)写出反应①中氧化还原反应的离子方程式: ____________。
(2)向反应①后的溶液中加浓氨水的目的是: ________________。
(3)反应②生成CaO2·8H2O的化学反应方程式为_____________。
(4)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①________;②_________。
(5)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。已知:I2+2S2O===2I-+S4O。
①CaO2的质量分数为_____________(用字母表示)。
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能___(填“不受影响”“偏低”或“偏高”),原因是____________
18(16分)有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应;F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。


请回答:
(1)B、F的结构简式分别为________、________。
(2)反应①~⑦中,属于消去反应的是________(填反应序号)。
(3)D发生银镜反应的化学方程式为__________;反应⑦的化学方程式为____
(4)A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为________。
(5)符合下列条件的F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1∶1∶2∶6
2018年高考必做化学试题答案
1.A2.C3.A4.D5.A6.A7.C8.D9.C10.D11.D12.D13.A14.C
15答案:(1)冷凝升化的碘单质,防止扩散到烧杯外
(2)C
(3)抑制Fe3+水解
(4)14.94
(5)2CuI+8HNO3===2Cu(NO3)2+4NO2↑+I2+4H2O
(6)升华、a
16.答案:(1)导气、a (2)吸收溴蒸气
(3)Ⅲ中硝酸银溶液内出现淡黄色沉淀(或测反应后Ⅲ中硝酸银溶液的pH,其pH变小)
(4)反应结束后装置Ⅱ中存在大量的溴化氢,使Ⅰ中的水倒吸入Ⅱ中可以除去溴化氢气体,以免逸出污染空气、关闭K1和分液漏斗活塞,开启K2
(5)分馏(或蒸馏)
17.解析:(1)工业碳酸钙中含有FeCO3、MgCO3等杂质,其中FeCO3中Fe为+2价,具有还原性,能和稀硝酸发生氧化还原反应。
(2)通过流程图可知,加浓氨水用于调节溶液的pH,除去Mg2+、Fe3+。
(5)①测定实验过程中发生如下反应:

18.


(4)取反应①后的混合液少许,向其中加入稀硝酸至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子
(5)2
查看更多考试资讯相关内容,请点击考试资讯
